_________________________________________________________________________________
ย้อนในอดีตประมาณ400ปีก่อนคริสตกาล
ผู้กล่าวถึงอะตอมคนแรกคือ Democretus (คีโมครีตุส)
ได้กล่าวไว้ว่า อะตอมเป็นสิ่งที่เล็กที่สุด มีรูปร่างแตกต่างกันและไม่สามารถแบ่งแยกออกได้
John Dolton
แบบจำลองของจอหน ดอลตัน
จอหน ดอลตัน เป็นนักวิทยาศาสตรชาวอังกฤษได้รวบรวมเรื่องเกี่ยวกับอะตอมและตั้งเป็นทฤษฎีขึ้นเรียกว่า
ทฤษฎีอะตอมของดาลตัน
ซึ่งนับเป็นก้าวแรกที่ทำให้เกิดความเข้าใจเกี่ยวกับอะตอมมากขึ้น
ทฤษฎีอะตอมของดาลตันมีใจความสำคัญดังนี้
1. สารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุดเรียกว่าอะตอม
ซึ่งไม่สามารถแบ่งแยกและทำให้สูญหายได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันและจะมีสมบัติต่างจากอะตอมธาตุอื่น
3. สารประกอบเกิดจากอะตอมมากกว่า1ชนิด
ทำปฏิกิริยาในอัตราส่วนน้อยๆ ตัวอย่างเช่น H20 CO2
ข้อจำกัดที่ไม่สามารถอธิบายได้คือ อะตอมยังสามารถแบ่งแยกได้อีก แบ่งเป็นอิเล็กตรอน โปรตอน และนิวตรอน)
และอะตอมของธาตุชนิดเดียวกันอาจมีมวลต่างกันได้
Josephn Jonh Thomson
แบบจำลองของทอมสัน
โจเซฟ จอห์น ทอมสัน เป็นนักฟิสิกส์ชาวอังกฤษได้สนใจปรากฏการณที่เกิดขึ้นในหลอดรังสีแคโทดจึงทำการทดลองเดี่ยวกับการนำไฟฟ้าของแก๊ส
หลอดรังสีแคโทดของ WilliamCrookes
วิลเลียมครูกส์ ได้สร้างหลอดรังสีแคโทดขึ้นมาเพื่อทดลองการนำไฟฟ้าของก๊าซซึ่งเขาสรุปผลการทดลองได้ว่า
“ก๊าซจะนำไฟฟ้าได้ดี เมื่อก๊าซนั้นมีความกดดันต่ำๆ
และความต่างศักย์ไฟฟ้ามีค่าสูงๆ” เนื่องจาก
เกิดรังสีพุ่งออกมาจากแคโทดไปยังแอโนด เรียกรังสีนี้ว่า รังสีแคโทด
และเรียกหลอกแก้วชนิดนี้ว่า หลอดรังสีแคโทด
หลอดรังสีแคโทดของ Tomson
 ทอมสันได้ทำการทดลองโดยการ บรรจุแก๊สชนิดหนึ่งไว้ในหลอดแก้วที่ต่อไว้กับเครื่องสูบอากาศ
โดยเจาะตรงกลางที่แอโนด และต่อกับเครื่องกำดนิดไฟฟ้ากรแสตรงความต่างศักย์สูง
ทางปลายหลอดมีฉากเรืองแสงรองรับอยู่ พบว่าเมื่อลดความดันในหลอดแก้วให้ต่ำลงจนเกือบเป็นสุญญากาศ
จะมีจุดสว่างเกิดขึ้นตรงบริเวณศูนย์กลางของฉากเรืองแสง
ทอมสันได้ทำการทดลองโดยการ บรรจุแก๊สชนิดหนึ่งไว้ในหลอดแก้วที่ต่อไว้กับเครื่องสูบอากาศ
โดยเจาะตรงกลางที่แอโนด และต่อกับเครื่องกำดนิดไฟฟ้ากรแสตรงความต่างศักย์สูง
ทางปลายหลอดมีฉากเรืองแสงรองรับอยู่ พบว่าเมื่อลดความดันในหลอดแก้วให้ต่ำลงจนเกือบเป็นสุญญากาศ
จะมีจุดสว่างเกิดขึ้นตรงบริเวณศูนย์กลางของฉากเรืองแสง
หลังจากนั้นต่อมาทอมสันได้ทำการเพิ่มขั้วไฟฟ้าอีก2ขั้วในแนวดิ่ง พบว่า
ตำแหน่งของจุดสว่างบนฉากเรืองแสงได้เบนเข้าหาขั้วบวกของสนามไฟฟ้า
จึงสรุปได้ว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุไฟฟ้าลบ
เมื่อทอมสันทดลองเปลี่ยนชนิดของแก๊สที่บรรจุในหลอดและโลหะที่ใช้เป็นแคโทด
พบว่ารังสีที่เกิดขึ้นยังคงประกอบด้วยอนุภาคที่มีประจุลบพุ่งมากที่ฉากเรืองแสงเหมือนเดิม
เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m) ของอนุภาคพบว่าได้ค่าเท่ากับ 1.76x10^8 คูลอมบ์ต่อกรัมทุกครั้ง
จากผลการทดลองและการคำนวณช่วยให้ทอมสันสรุปได้ว่าอะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ
และเรียกอนุภาคนี้ว่า อิเล็กตรอน
______________________________________________________________________________
Robert Andrews Millikan
มิลลิแกน ได้ทำการทดลองเพื่อหาค่าประจุของอิเล็กตรอนโดยวิธีหยดน้ำมัน
ทำได้โดย พ่นน้ำมันเป็นละอองเม็ดเล็ก ๆ ให้ตกลงมาระหว่างแผ่นโลหะ 2 แผ่น
แล้วใช้รังสีเอกซ์ไปดึงอิเล็กตรอนออกจากอะตอมของแก๊สในอากาศ แล้วให้อิเล็กตรอนไปเกาะหยดน้ำมัน
พบว่า แต่ละหยดน้ำมันมีอิเล็กตรอนมาเกาะจำนวนไม่เท่ากัน นั่นคือ
หยดน้ำมันบางหยดมีอิเล็กตรอนเกาะติดเพียงตัวเดียว บางหยดก็มีมากกว่า 1 ตัว
หยดน้ำมันจะตกลงมาตามแรงโน้มถ่วงของโลก
จากนั้นให้กระแสไฟฟ้าเข้าไปในแผ่นประจุบวกและลบ แผ่นประจุลบซึ่งอยู่ด้านล่างผลักหยดน้ำมันที่มีอิเล็กตรอนมาเกาะจนหยุดนิ่ง
ซึ่งดูได้ด้วยกล้องจุลทรรศน์(microscope) แสดงว่า แรงโน้มถ่วงของโลกเท่ากับแรงจากสนามไฟฟ้า แล้วคำนวณหาค่าประจุ
มิลลิแกนสรุปว่าค่าประจุไฟฟ้าต่ำสุดที่เกิดขึ้นบนละอองน้ำมันคือประจุไฟฟ้าของอิเล็กตรอน
เกิดจากละอองน้ำมันดังกล่าวมีอิเล็กตรอนไปเกาะอยู่ 1 ตัว
ถ้าละอองน้ำมันใดมีอิเล็กตรอนไปเกาะ อยู่ 2
3 4 ... ตัว
ประจุไฟฟ้าที่เกิดขึ้นบนละอองน้ำมันนั้นก็จะเพิ่มเป็น 2
3 4 ... เท่าของ -1.6
x 10-19 คูลอมบ์
ฉะนั้นประจุไฟฟ้าของอิเล็กตรอนจึงมีค่าเท่ากับ - 1.6 x 10-19 คูลอมบ์

เมื่อทราบประจุของอิเล็กตรอนแล้ว
จึงแทนค่าประจุไฟฟ้าของอิเล็กตรอน
(e) ไปลงในสมการของทอมสัน จะคำนวณหามวล (m) ของอิเล็กตรอนได้
จากผลการทดลองมิลลิแกนคำนวณหาค่าประจุของอิเล็กตรอนได้คือ 1.60 X 10-19 คูลอมบ์ ซึ่งเป็นค่าประจุของอิเล็กตรอน 1 อิเล็กตรอน
จากการทดลองของมิลลิแกน
เราทราบค่า e = 1.60 X 10-19 คูลอมบ์
จากการทดลองของทอมสัน เราทราบค่า e/m = 1.76 X
108 คูลอมบ์/กรัม
แทนค่า 1.60 X 10-19/m
= 1.76 X 108
m = 9.11 X 10-28 กรัม
ดังนั้น
เราจะทราบมวลของอิเล็กตรอนเท่ากับ 9.11 X 10-28 กรัม
______________________________________________________________________________
______________________________________________________________________________
Eugen Goldstein
ออยแกน โกลด์สไตน์
นักฟิสิกส์ชาวเยอรมัน
ได้แสดงให้เห็นว่า
ถ้ามีการดัดแปลงหลอดรังสีแคโดโดยให้ขั้วแคโทด อยู่เกือบ
ตรงกลางและเจาะรูขั้วแคโทด
จะสังเกตเห็นรังสีหลังขั้วแคโทด รังสีนี้เคลื่อนที่เป็นเส้นตรง เมื่อศึกษาสมบัติตรงข้ามกับรังสีแคโทด
คือเบี่ยงเบนในสนามแม่เหล็กในทิศทางตรงข้ามกับรังสีแคโทด
ในสนามไฟฟ้ารังสีนี้เบี่ยงเบนเข้าหาขั้วลบ และทำให้ฉากเรืองแสงได้
ทำให้สรุปได้ว่ารังสีที่พบใหม่นี้ประกอบด้วยอนุภาค ที่มีประจุไฟฟ้าบวก เรียกว่า
รังสีบวก หรือรังสีแคแนล
อนุภาคบวกนี้เกิดจากอะตอมของก๊าซถูกชนด้วยอนุภาคอิเล็กตรอน ที่พุ่งออกมาจากแคโทด ทำให้อิเล็กตรอนหลุดออกจากอะตอม อะตอมจะกลายเป็นประจุบวก อนุภาคนี้จึงเคลื่อนที่เข้าหาขั้วลบ และพบว่าเมื่อเปลี่ยนชนิดของก๊าซที่บรรจุ
อนุภาคนี้จะมีค่าประจุต่อมวลไม่คงที่ขึ้นอยู่กับก๊าซที่บรรจุ จากการทดลองพบว่าถ้าใช้ก๊าซไฮโดรเจน
จะอนุภาคบวกที่มีขนาดประจุเท่ากับอิเล็กตรอนและมีค่าประจุต่อมวลสูงสุด เรียกอนุภาคนี้ว่า โปรตอน
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก.
และฉากเรืองแสง ข. โกลสไตน์ได้อธิบายว่า
จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก.
จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก
เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง
แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ
หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่ โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน
ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน
ปรากฏว่า
ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากแก๊ส
ไม่ได้เกิดจากขั้วไฟฟ้า
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์
ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้
อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ
กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
______________________________________________________________________________
Ernest Rutherford
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด (Lord Ernest Rutherford) ได้ศึกษาแบบจำลองอะตอมของทอมสัน
และเกิดความสงสัยว่าอะตอมจะมีโครงสร้างตามแบบจำลองของทอมสันจริงหรือไม่ โดยตั้งสมมติฐานว่า “ถ้าอะตอมมีโครงสร้างตามแบบจำลองของทอมสันจริง ดังนั้นเมื่อยิงอนุภาคแอลฟาซึ่งมีประจุไฟฟ้าเป็นบวกเข้าไปในอะตอม
แอลฟาทุกอนุภาคจะทะลุผ่านเป็นเส้นตรงทั้งหมดเนื่องจากอะตอมมีความหนาแน่นสม่ำเสมอเหมือนกันหมดทั้งอะตอม”
รัทเทอร์ฟอร์ดจึงได้ทดลองยิงอนุภาคแอลฟา
(รังสีบวก) ไปยังทองคำ และใช้ฉากเรืองแสง ZnS โค้งรอบแผ่นทองคำ พบว่า ส่วนใหญ่ทะลุผ้านเป็นเส้นตรง ส่วนน้อยเบี่ยงเบน
และส่วนน้อยมากสะท้อนกลับ
จากผลการทดลองสรุปได้ว่า
1.การมี่อนุภาคแอลฟาวิ่งผ่านแผ่นทองคำได้เป็นส่วนใหญ่เพราะว่าภายในอะตอมมีที่ว่างอยู่มาก
2. การที่อนุภาคแอลฟาเบี่ยงเบนเพราะวาภายในน่าจะมีอนุภาคบวกที่มีมวลสูงมากกว่าอนุภาคแอลฟาและมีประจุบวกจึงถูกผลักให้เบนออก
3. การที่อนุภาคสะท้อนกลับมาบริเวณข้างหน้าดพราะว่าอนุภาคแอลฟาวิ่งชนกับอนุภาคบวกจึงทำให้เกิดการสะท้อนกลับ
จากการทดลอง รัทเทอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมใหม่ว่า
อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ภายในและมีประจุไฟฟ้าเป็นบวก
โดยมีอิเล็กตรอนวิ่งอยู่รอบๆ
______________________________________________________________________________
Sir James Chadwick
หลังจากการค้นพบโปรตอนและอิเล็กตรอนและนิวเคลียสแล้วยังพบว่าประมาณครั้งหนึ่งของมวลนิวเคลียสเป็นโปรตอนเนื่องจากอิเล็กตรอนมีมวลน้อยมาก
ดังนั้นภายในนิวเคลียสจะต้องมีอนุภาคอื่นอีกที่มีประจุเป็นศูนย์ และมีมวลเกือบเท่ากับมวลของโปรตอน
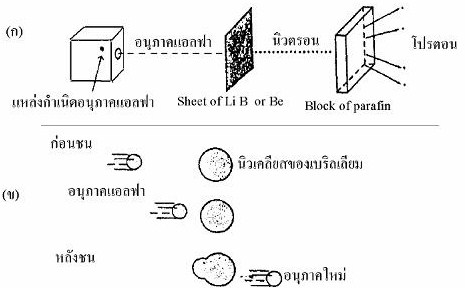
ในปี ค.ศ. 1932 แชดวิก (J. Chadwick) ได้ท้าการทดลองยิง
(bombard) ธาตุเบริลเลียม (Beryllium, Be) ด้วยอนุภาคแอลฟาพบว่า
มีอนุภาคที่มีพลังงานสูงแต่ไม่มีประจุถูกปลดปล่อยออกมาเรียกอนุภาคนี้ว่านิวตรอน (neutron)
จากการค้นพบอิเล็กตรอน โปรตอนและนิวตรอน จึงได้ข้อสรุปว่าอะตอมประกอบด้วย
อนุภาคมูลฐาน 3 อย่าง คือ อิเล็กตรอน
(e) โปรตอน (p) และนิวตรอน (n) สมบัติดังตารางที่ 1.1
โดยบริเวณใจกลางเป็นนิวเคลียสที่มีความหนาแน่นสูง
เนื่องจากภายในมีโปรตอนและนิวตรอนมีมวลเกือบเท่ามวลของอะตอม ส่วนรอบๆ นิวเคลียส
จะมีอิเล็กตรอนวิ่งวนอยู่รอบๆ โดยนิวเคลียสมีขนาดเส้นผ่าศูนย์กลาง ประมาณ 10-13 เซนติเมตร ขณะที่อะตอมมีเส้นผ่าศูนย์กลางมีขนาด 10-8 เซนติเมตร
คำถามท้ายบท
1.) ข้อใดไม่ใช่แบบจำลองของดอลตัน?
ก. อะตอมมีขนาดเล็กไม่สามารถแยกได้แบ่ง
ข. อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกัน
ค. ในอะตอมมีอิเล็กตรอน
ง. ธาตุจะทำปฏิกิริยาด้วยอัตราส่วนน้อยๆ
2.) การทดลองโดยใช้หลอดรังสีแคโทดทำให้เราทราบเกี่ยวกับอะไร?
ก. อนุภาคแอลฟามีประจุบวกและหนักกว่าโปรตอน
ข. อนุภาคที่มีประจุไฟฟ้าเป็นบวกมีอัตราส่วนประจุต่อมวลไม่เท่ากัน
ข. อนุภาคที่มีประจุไฟฟ้าเป็นบวกมีอัตราส่วนประจุต่อมวลไม่เท่ากัน
ค. ในนิวเคลียสมีโปรตอน
ง. สสารทุกขนิดประกอบด้วยอิเล็กตรอน
ง. สสารทุกขนิดประกอบด้วยอิเล็กตรอน
3.) การทดลองของมิลลิแกนเป็นการทดลองเพื่อหา?
ก. ประจุบนหยดน้ำมัน
ข. e/m ของอิเล็กตรอน
ค. ประจุของอิเล็กตรอน
ง. มวลของโปรตอน
4.) จากการทดลองของโกลด์สไตน์ทำให้เราค้นพบ ?
ก. มวลของนิวตรอน
ข. e/m ของอิเล็กตรอน
ค. e/m ของโปรตอน
ง. มวลของโปรตอน
5.) เพราะเหตุใดการคิดมวลของธาตุจึงไม่คิดมวลของอิเล็กตรอน?
ก. อิเล็กตรอนมีค่าเป็นกลาง
ข. มวลของอิเล็กตรอนมีค่าเท่ากับมวลของโปรตอน
ค. มวลของอิเล็กตรอนเบามาก
ง. ไม่มีนักวิทยาศาสตร์คนใดหาข้อสรุปได้
6.) แบบจำลองอะตอมของทอมสันและรัทเทอร์ฟอร์ดแตกต่างกันอย่างไร?
ก. ตำแหน่งของอนุภาคในโปรตอน
ข. ขนาดของอนุภาคในอะตอม
ค. จำนวนอนุภาคในอะตอม
ง. ชนิดของอนุภาคในอะตอม
7.) ประจุของนิวตรอนมีค่าเป็นอย่างไร?
ก. มีค่าเป็นบวก
ข. มีค่าเป็นกลาง
ค. มีค่าเป็นลบ
ง. มีค่าเป็นลบและเป็นกลาง
8.) ข้อใดเป็นแบบจำลองของทอมสัน?
ก. มีลักษณะเป็นทรงกลมข้างในว่างเปล่า
ข. มีบวกและลบกระจายกันอยู่เท่าๆกัน
ค. มีอิเล็กตรอนอยู่รอบๆและมีนิวเคลียสตรงกลาง
ง. ไม่มีข้อใดถูกต้อง
9.) แบบจำลองอะตอมของทอมสันและรัทเทอร์ฟอร์ดแตกต่างกันอย่างไร?
ก. รังสีบวกดกิดจากแก๊สที่บรรจุภายใน
ข. รังสีบวกไม่มีประจุไม่มีมวล
ค. รังสีบวกมีมวลเท่ากันเสมอ
ง. รังสีบวกมีประจุคงที่
10.) เมื่อเราตั้งสมมุติฐานว่าอะตอมประกอบด้วยนิวเคลียส ซึ่งมีขนาดเล็กและมีประจุบวกนั้น เพราะ?
ก.โดยทั่วไปโลหะนำไฟฟ้าได้ดี
ข.ในการทำอิเล๋กโทรลืซิลของเกลือทั้งไฮโดรเจนจะไปรับอิเล็กตรอนที่แคโทด
ค.ในแมสสเปกโทรมิเตอร์จะมีไอออนบวกเกิดขึ้น
ง.อนุภาคแอลฟาบสงส่วนเมื่อชนกับแผ่นโลหะบางๆ จะเบนไปขากแนวเส้นตรงหรือสะท้อนกลับ
--------------------------------------------------------------------------------------------
เฉลย
1.) ค
2.) ง
3.) ก
4.) ง
5.) ค
6.) ก
7.) ข
8.) ก
9.) ก
10.) ง